생리대, 마스크, 반창고, 외용소독제, 치약, 콘택트렌즈관리용품 등 의약외품 용기·포장 등에 시각·청각장애인을 위해 점자 및 음성·수어영상변환용 코드 표시를 의무적으로 표시해야 한다.
식약처는 26일 ‘의약외품 표시에 관한 규정’의 일부 개정안 관련 의견 조회를 11월 13일까지 받는다고 밝혔다.
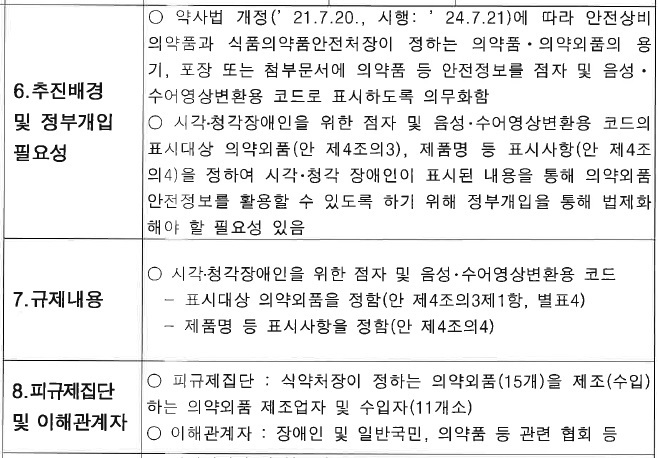
기존 규정은 의약외품 제조 또는 수입업자는 용기나 포장에 제품 명칭, 제조번호와 유효기한 또는 사용기한 등을 활자로 적도록 하고 있고, 시각장애인을 위한 점자 표기를 권장하고 있다.
하지만 의약외품 중 점자를 표기하는 제품은 거의 없어 시각장애인 등은 의약외품 오남용 우려가 있으며, 안전 정보를 알기 어렵다는 지적이 있어 왔다. 앞서 약사법은 21년 7월 20일자로 개정 공포되었으며, 24년 7월 21일자로 시행 예정이다. 의약외품은 식약처장의 고시에 의해 시행된다.
식약처는 “입법 취지와 정책효과를 고려하여 점자표시 대상을 의약외품 중 특정 품목군의 다소비 제품(생산실적 상위제품으로 식약처장이 지정)으로 하고 점자 등 표시내용은 품목군별 특성을 고려해 필수 표시내용을 지정·규제한다”고 설명했다.
업계 영세성, 생산단가 상승, 무역장벽 우려, 업계 수용도 등을 고려할 때 기술규제 영향, 시장경쟁적 제한 요소 등은 없다고 덧붙였다. 물론 식약처장이 정한 품목을 제조(수입)하는 업체는 불가피하게 추가비용이 발생해, 제품 가격 상승이 우려되나 장애인의 의약외품 안전사용을 위한 사회적 기여 및 자사 제품 사용에 안전정보를 활용할 수 있어 긍정적인 측면도 있다고 봤다.
유럽은 제품명과 의약품 성분 함량(strength)의 점자표시는 의무 사항이며, 의약품의 제형·대상·유효기간은 권장사항이다. 또 의약품 점자포시 규격으로 마버그 미디엄 점자 표준을 권장하며, 해당 표준은 점 높이를 제외한 점 간격(2.5㎜), 글자 간격(6.0㎜), 줄 간격(10.0㎜), 점 지름(1.3~1.6㎜)을 규정하고 있다.
미국과 캐나다는 의약품 점자표시 가이드라인(Can-Am Braile)을 제정해 시행 중이다.
한편 작년 3월부터 장애인 의약외품 안전사용 정책협의회체가 구성, 운영 중이며, 품목군 및 적용범위, 표시사항, 표시 기준·방법 등을 논의하고 있다. 또한 의약외품 안전정보 장애인 접근성 개선 용역사업이 수행 중으로 향후 개정사항을 안내, 홍보한다는 계획이다. 기존 규정에 따라 표시된 부자재는 시행일 이후 1년이 되는 날까지 사용 가능하는 경과조치를 부여한다.