미국이 코로나19로 인해 FDA의 OTC Drug 관련 신속한 명령체계로 바꿈에 따라 향후 자외선차단제 심사 처리가 빨라지게 됐다. 이와 관련 대한화장품협회는 ‘OTC 모노그래프 개혁’ 해설자료를 냈다.
코로나19 확산으로 미국 내 감염자 수가 급증하자 미국은 2020년 3월 27일 ‘CARES Act’를 통과시켰다. 이 법률은 팬데믹에 따른 위기 극복을 위한 미국의 3차 대응으로 ▲division A(근로자 임금 및 고용유지, 의료보건체계 가오하, 경제안정화 등에 관한 사항) ▲division B(코로나19 대흥 기관 및 응급시스템 개선을 위한 긴급지출에 관한 사항)으로 나뉜다.
디비전B 내용 중 Title 3-subtitle F에는 미국의 OTC monograph drugs 관련 규제 개혁과 현대화에 대한 내용이 포함되어 있다. 즉 낙후되고 느린 미국 OTC 의약품 체계에 대한 전면적인 개혁안이다.
FDA는 OTC 모노그래프 제도를 운용 중인데 ‘CARES Act’를 통해 현대화 한다는 계획이다. 즉 기존 스폰서 요구에 의한 절차를 FDA 행정 명령으로 대체하는 절차다. 이렇게 되면 지지부진하던 원료의 안전성, 유효성 검토가 FDA의 명령에 따라 신속하게 진행될 수 있다.
그 중 대표적인 게 ‘자외선차단제 혁신법’이다. 이 법안이 발효되기 전 FDA는 몇몇 자외선 차단제 성분에 대한 검토 결과 발표를 13년째 미루고 있었다. 이에 따라 아시아, 유럽 등 세계 각지에서 사용되는 자외선 차단제가 FDA의 승인이 늦어져 미국에서 판매되지 못했다. 이를 보다 못한 오바마 대통령이 2014년 11월 26일 FDA의 OTC(over-the-counter) 자외선 차단제 승인을 가속화하는 ‘자외선 차단제 혁신법’(Sunscreen Innovation Act)을 승인했다.
‘자외선 차단제 혁신법’은 미국에서 OTC Drug으로 분류되는 자외선 차단제의 성분에 대해FDA가 검토 및 승인을 내리는 속도를 가속화 하는 것을 목표로 하는 법안이다. 새로운 자외선 차단제 원료에 대해서는 업체 또는 개인의 새로운 원료 승인 요청 이후 60일 내에 검토 가능 여부를 발표해야 하며 이후 45일 이상의 의견수렴을 거쳐 정보를 수집, 승인요청 300일 안에 규제 변경안 발표를 의무화하는 내용이었다.
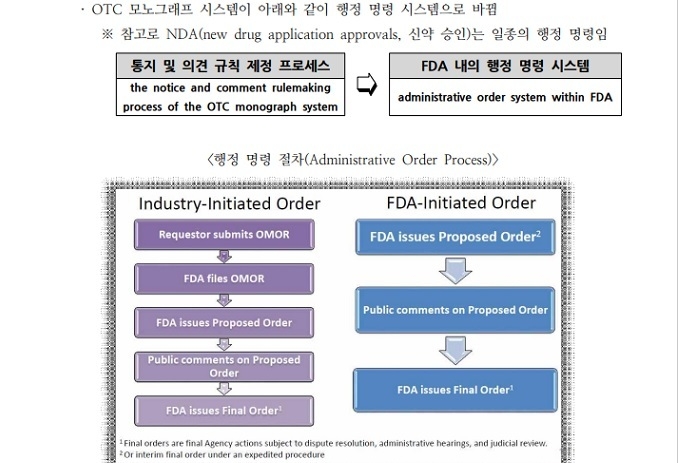
그런데 새로운 CARES Act 의 section 3854로 인해 자외선차단제 혁신법(SIA)은 2020년 9월 30일에 자동 폐지(sunset)된다.
그때까지, 자외선차단제 명령(order)의 대상이 된 비처방 자외선차단제 활성 성분의 스폰서(sponsor)는 △ 자외선차단제 혁신법(SIA) 조항에 따라 검토를 지속하는 것 또는 △ 모노그래프 의약품의 새로운 행정 명령 하에서 검토를 하는 것 중에 선택을 할 수 있다.
만약 스폰서가 행정 명령 절차 하에 있는 검토를 선택하면, 제안된 자외선 차단제 명령(order)은 신청 접수가 완료된 행정명령 요청으로 바뀌게 된다. 이렇게 되면 최종 자외선 차단제 명령은 자동으로 최종 행정 명령으로 간주되며, 또한 스폰서는 제안된 자외선 차단제 명령과 관련하여 비밀회의를 요청할 수 있다.
최종자외선차단제 명령은 이전에 자외선차단제 모노그래프 성분으로 판매되지 않은 자외선차단제 활성 성분을 허용하는 경우, 요청자가 자외선차단제 성분을 합법적으로 판매 할 수 있는 날짜부터 18개월 동안 요청자에게 독점권을 제공한다.
FDA는 늦어도 법 제정일로부터 18개월 이내에 OTC(비처방) 자외선차단제에 관한 제안된 행정 명령을 발행해야 한다. 최종 행정 명령은 명령 발효일 최소 1년 전에 발행되어야 한다. 이에 따라 OTC 심사절차는 18개월을 넘지 않게 된다.
코로나19가 오랜 심사와 절차를 요구해, 미국시장 진출을 막는 진입장벽으로 여겨지던 FDA 모노그래프 제도를 개혁하게 된 것이다.






























